צעד 5

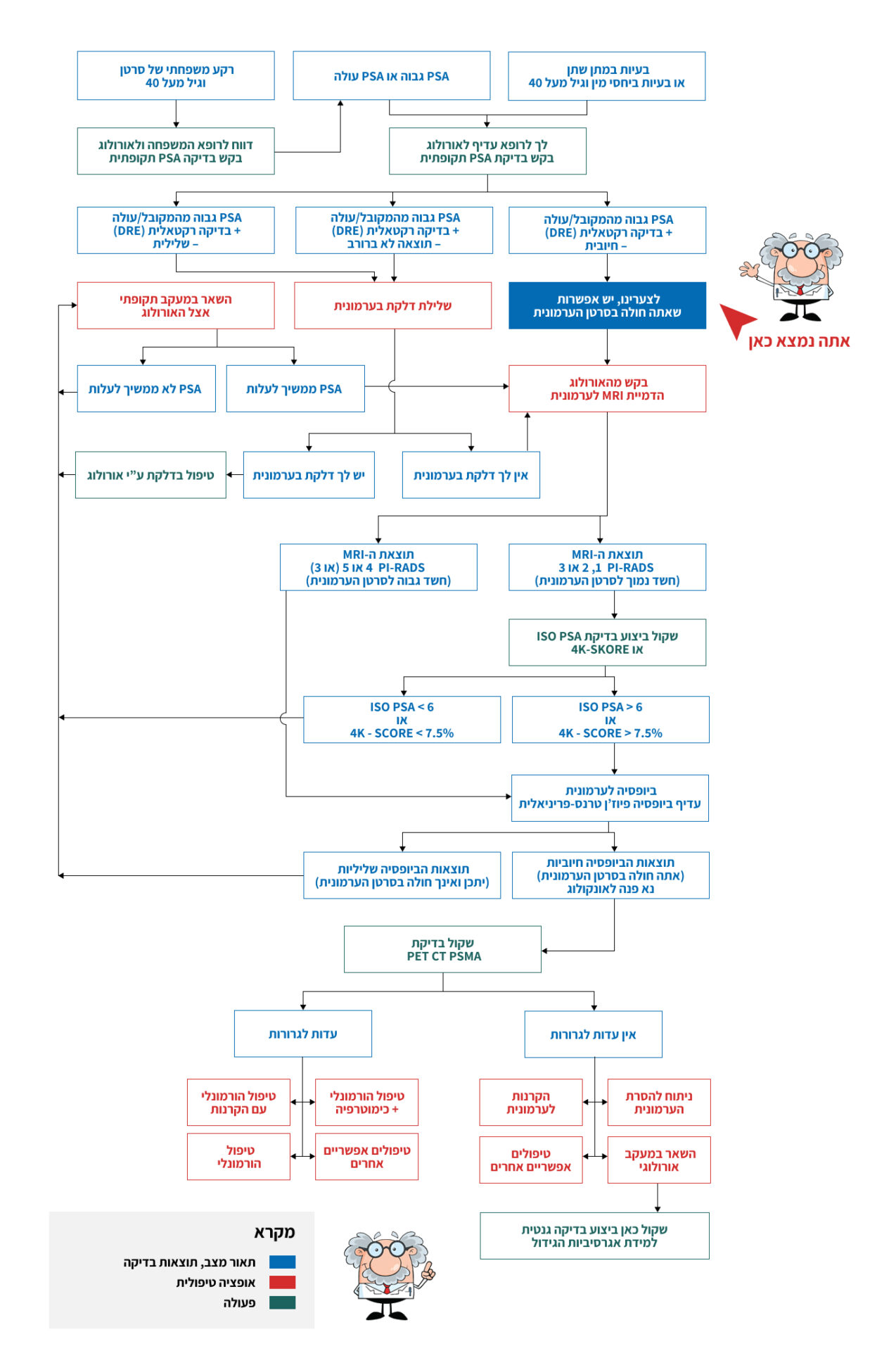
לצערינו, יש אפשרות שאתה חולה בסרטן הערמונית
מידע נוסף
מטרת פרק זה הינה להביא את המטופל לידי החלטה מושכלת וחכמה האם לבצע ביופסיה לערמונית
הקדמה –
מאחר וההסברים הרלוונטיים בפרק הזה מורכבים ואף ארוכים במידת מה, מומלץ למטופל לקרוא בעיון ולהפנים את הכתוב כך שיוכל לעשות את ההחלטה הקשה אך הנכונה האם ואיך לבצע ביופסיה לערמונית.
קיימות כיום מספר בדיקות חדשניות שעשויות לעזור בקבלת ההחלטה האם לבצע ביופסיה ואם כן אז איזה ביופסיה (כיום קיימות שתי טכניקות שונות לביצוע ביופסיה).
בהמשך הפרק הזה – הסברים על הביופסיה עצמה, על הבדיקות טרום ביופסיה ועל קבלת ההחלטה אם ואיזה ביופסיה לבצע.
מפת דרכים להחלטה על ביצוע הביופסיה
בסוף הפרק אני מציג מפת דרכים גרפית על מנת לעזור בקבלת החלטה מושכלת האם לבצע או לא לבצע ביופסיה ואם כן איזה סוג.
הערה חשובה – מאחר והכותב אינו רופא והכתוב מבוסס על הידע שרכש כחולה סרטן ערמונית – במשך שנים, אין לראות בכתוב משום הוראה או המלצה רפואית. החלטה על הביופסיה, כמו גם כל החלטה רפואית אחרת, יש לקבל בסיכום עם הצוות הרפואי המוסמך.
1. מהי ביופסיה לערמונית?
ביופסיה לערמונית הינו תהליך שבו מוציאים דגימות זעירות של רקמה מהערמונית למטופלים שיש חשד שלקו בסרטן הערמונית. אם מתגלות בדגימה אחת, או יותר, רקמה סרטנית אזי זהו האישור הסופי והמוחלט שהנבדק אכן לקה בסרטן הערמונית.
את הדגימות בודקים אותן תחת מיקרוסקופ כדי לגלות:
- האם יש רקמה סרטנית בדגימות שהוצאו.
- באיזה מיקום ממוקמת הרקמה הסרטנית. יש חשיבות רבה לפרמטר זה שכן אין דין רקמה סרטנית הקרובה לדופן הערמונית כדין רקמה סרטנית הנמצאת קרוב למרכז הערמונית. מיקום הרקמה הסרטנית משפיע על ההחלטה מהו דרך הטיפול הטובה ביותר כפונקציה של המיקום.
- כמה אחוזים מתוך כל דגימה היא סרטנית. ככל שאחוזי הרקמה הסרטנית בדגימות יותר גבוהים הדבר מעיד על התפשטות יותר נרחבת של הסרטן.
- מהו הסוג הספציפי של הסרטן בדגימה (הנפוץ ביותר נקרא אדנוקרצינומה). אדנוקרצינומה, Adenocarcinoma – סרטן אשר מתפתח באברים פנימיים מסוימים ויש לו תכונות דומות לבלוטה. (משחרר חומר כלשהו לתוך הגוף). זהו סוג סרטן הערמונית הנפוץ ביותר.
- מהי האגרסיביות של הרקמה הסרטנית (מדד גליסון).
- דימום מהרקטום שנפסק בד"כ אחרי כמה ימים
- דם בזרע – בד"כ יש מעט צבע דם (צבע חלודה) בזרע. זה לא סיבה לדאגה מיוחדת ויכול להמשך מספר שבועות לאחר הביופסיה.
- עקבות דם בשתן
- קשיים בהשתנה – תופעה די נדירה שחולפת תוך זמן לא רב לאחר הביופסיה.
- זיהום בדרכי השתן או בערמונית- תופעה די נדירה. יש לפנות לטיפול רופא באמצעות אנטיביוטיקה.
הסבר לגבי דרוג GLEASON
דרוג גליסון הינו מדד לחומרה ואגרסיביות של המחלה.
דרוג גליסון נקבע לאחר שדגימות הביופסיה שהוצאו מהערמונית (או לחילופין בדיקה של ערמונית שלמה שהוצאה בניתוח להסרת הערמונית) נבדקות, תחת מיקרוסקופ, ע"י רופא פתולוג המחפש תאים אבנורמליים (לא נורמאליים), תאים שאיבדו את צורתם הטבעית ורקמה שאיבדה את צורתה המקורית. כל תא שנראה סרטני נבדק ומדורג על פי סולם שנקרא GLEASON. מידת האבנורמליות של התא מתבטאת בדרגה שלו בסולם GLEASON. הדרגה הגבוהה ביותר בסולם GLEASON היא 5 והנמוכה ביותר הוא 1. ככל שדרגת ה- GLEASON גבוהה יותר, דרגת החומרה של המחלה גדולה יותר והסרטן אגרסיבי יותר, וכמובן, גדול יותר הסיכון שהסרטן אינו מוגבל רק לערמונית אלא התפשט ממנה והלאה.
דרגת הגליסון הנרשמת בדוח של הפתולוג היא סכום של 2 מספרים (כל אחד בסולם של 1-5).
סה"כ דרגת הגליסון נותנת את המידע לגבי חומרת הגידול.
מהם שני המספרים?
המספר הראשון (הנכתב משמאל) נקבע ע"י סוג התאים בדגימה המהווים 51% או יותר מהתאים הנצפים בדגימה. המספר השני הוא דרגת התאים המצויים בשיעור של לפחות 5% מהדגימה אבל פחות מ- 50%, כלומר בין 5% ל- 49%. סה"כ סכום שני המספרים נותן את דרגת גליסון בסולם של מ- 2 (תקין) ועד 10 (חמור ביותר). למשל: לאדם שיש לו דרגת גליסון של – 7 = 3 + 4 משמעותו שיותר מ- 50% מהתאים בדגימה מראים דרגה 4 ואילו פחות מ- 49% בדגימה מראים דרגה 3.
אדם שיש לו את אותה דרגת גליסון אבל המספרים הם: 7= 4 + 3, מצבו טוב יותר, מפני שיותר מ- 50% מהתאים הם בדרגה 3 והמיעוט הוא בדרגה הגבוהה יותר – דרגה 4.
למעבר לתמונה המדגימה את ההבדלים באופי התאים בסולם גליסון (כאשר בדרגה 1 (בצבע הירוק) המבנה ופיזור של התאים תקין ובצד השני, בדרגה 5 (באדום) האי-סדר והפיזור שלהם מכסימלי) : הקש כאן
2. הסבר לגבי הטכניקות השונות לביצוע הביופסיה
ביופסיה לערמונית נעשית ע"מ לאבחן, באופן סופי, חולים בסרטן הערמונית.
הביופסיה שהייתה נהוגה בעבר הינה למעשה "ביופסיה עיוורת". היא נעשית תחת תמונת אולטרה סאונד המתקבלת ממתמר המוכנס לפי הטבעת של הנבדק ומציג, על צג המחשב של הרופא המבצע את מיקום וגבולות הערמונית. למרות זאת, בהרבה מקרים תמונת האולטרה סאונד, של הערמונית, אינה מאפשרת להבחין ברקמה הסרטנית וכתוצאה מכך קורים מקרים שהדגימות מהערמונית נלקחות רק מהרקמה הבריאה ולא מהרקמה הנגועה.
כך קורה שמטופל שעבר ביופסיה עיוורת ובאופן שגוי לא נמצאה רקמה סרטנית בערמונית שלו למרות שיש לו סרטן בערמונית.
השגיאות שעלולות לנבוע מביצוע ביופסיה עיוורת הם:
- אי אבחון – בדגימות שהוציא הרופא המבצע לא נמצאה רקמה סרטנית. כל הדגימות שהוצאו היו רק מהרקמה הבריאה, זאת למרות שבפועל קיימת בערמונית רקמה סרטנית.
- אבחון סרטן ברמת אגרסיביות נמוכה – לעיתים נמצאים בדגימות הביופסיה העיוורת תאים סרטניים שנדגמו משולי הרקמה הסרטנית ומתקבלת תוצאה של אגרסיביות נמוכה (מדד גליסון נמוך) ובפועל הרקמה הסרטנית הרבה יותר אגרסיבית (מדד גליסון גבוה). הדבר משתקף בבדיקות הפתולוגיות שנעשית לערמונית לאחר שמוציאים אותה מהגוף באמצעות ניתוח. שגיאה זו יכולה להביא לטיפול שגוי לחולה שזה עתה אובחן.
כיום מקובלת טכניקה משופרת לביצוע הביופסיה הנקראת Fusion biopsy (ביופסיה משולבת) שנעשית תוך שילוב (או היתוך) של הדמיית MRI מוקדמת של הערמונית עם תמונת האולטרה סאונד על הצג של הרופא המבצע את הביופסיה, ובזמן ביצוע הביופסיה, ומאפשרת את הוצאת הדגימות מהערמונית בדיוק מהמקום שבו ישנה רקמה סרטנית כפי שנראית בתמונת ה MRI.
לצורך הזה יש לבצע הדמיית MRI מוקדמת של הערמונית. בהדמיית ה MRI הרופאים שהתמחו בכך, רואים בד"כ היטב את מיקום הרקמה הסרטנית.
ביופסיה בטכניקה הזו מביאה כנראה לרמת גילוי של 85 עד 90 אחוז בעוד שרמת הגילוי של הביופסיה העיוורת הן בסביבת כ – 40 – 35 אחוז. טכניקה זו מביא לשיפור הדיוק באבחון שכן הדגימות בביופסיה פיוזן נלקחות ממרכז הרקמה החשודה כסרטנית ולא משוליה, כפי שעלול לקרות בביופסיה עיוורת.
למרות האמור לעיל בדיקת התוצאות במחקרים שנערכו בדיעבד (מחקרים רטרוספקטיביים), מראים הפרש הרבה יותר קטן ברמות הגילוי למשל בציטוט הבא: אחוזי גילוי (בביופסיה שניה, לאחר שהראשונה הייתה ביופסיה עיוורת) של 84.4% בביופסיה פיוז'ן מול 65.1% בביופסיה עיוורת.
ציטוט:
Clinically significant cancer was more commonly revealed by targeted biopsy (84.4%; 95% CI, 68.25–93.14) than by systematic biopsy (65.1%; 95% CI, 52.75–75.67)
יתרונות נוספים ל Fusion biopsy –
- מביא להפחתת מספר הביופסיות החוזרות שנעשות בביופסיה עיוורת, שכן השימוש בטכניקה הזו גורם לגילוי הרקמה הסרטנית באופן כמעט ודאי כבר בביופסיה הראשונה.
- מונע מצבים של החמרת המחלה הנגרמת כתוצאה מהזמן שחלף עד לגילויה.
חסרונותיה של ה – Fusion biopsy
- משך הזמן, עד לביצוע הביופסיה בפועל, הוא ארוך מאחר ויש להמתין לתור לביצוע MRI ולאחר מכן להמתין לפיענוח הדמיית הMRI ולאחר מכן יש להמתין לביצוע הביופסיה בפועל. תהליך שיכול לקחת כמה חודשים. מסיבה זו במקרים שה PSA גבוה והתגלתה בערמונית רקמה לא הומגנית/גושים, וברור שהסרטן מפושט בערמונית. במקרה כזה יש דחיפות לאבחון מהיר ולהתחלת הטיפול כדאי לבצע ביופסיה עיוורת הן כדי לחסוך זמן והן משום שסיכויי האבחון מאד גבוהים במצב הזה בביצוע ביופסיה עיוורת.
- מספר המרכזים הרפואיים שבהם מתבצעת ה- Fusion biopsy מצומצם יחסית. עובדה זו גם משפיעה על התארכות משך הזמן עד לביצוע הביופסיה הזו בפועל.
- הדמיית הMRI אינה מגלה ב 100% את הרקמה הסרטנית בערמונית. לעיתים (רחוקות אמנם אבל מקרים כאלו יתכנו) אין הרקמה הסרטנית מתגלה ב MRI. במקרים אלה, ללא גילוי של רקמה סרטנית אין משמעות לבצע את ה- Fusion biopsy.
קיימות שתי טכניקות לביצוע ביופסיה פיוז'ן
הטכניקה הוותיקה יותר הנקראת ביופסיה פיוז'ן טרנס רקטאלית שבמסגרתה מוכנס מתמר אולטרה-סאונד לפי הטבעת של הנבדק ובו מחט המסוגלת לחדור לערמונית מבעד לדופן פי הטבעת ולהוציא דגימה מהערמונית בעיקר מהאזורים החשודים כנגועים כפי שהודגמו בבדיקת ה MRI. היא נעשית בד"כ בהרדמה מקומית.
בגלל המעבר דרך פי הטבעת הסיכון לזיהום בטכניקה זו יוותר גבוה מאשר בטכניקה הטרנס-פרינאלית. ראה כאן
כמו כן לא ניתן להגיע ולהוציא דוגמאות מהחלק הקדמי של הערמונית.
תמונה של ביופסיה טרנס-רקטאלית ניתן לראות בקישור הבא
הביופסיה בטכניקה היותר מתקדמת נקראת ביופסיה פיוז'ן טרנס-פרינאלית. היא מבוצעת במסגרת אשפוז יום כירורגי, נעשית בהרדמה כללית ואורכת כרבע שעה. במסגרת הבדיקה הערמונית נלקחות דגימות ייעודיות מאזורים חשודים כפי שהודגם בהדמיית ה MRI.
לסיכום, לביופסיה טרנס פריניאלית 3 יתרונות חשובים, ביחס לביופסיה טרנס רקטאלית ואלו הם:
- הסיכון לזיהומים נמוך יותר
- היכולת להוציא דגימות מכל נפח הערמונית.
- בניסוי השוואתי נמצא כי יכולת הגילוי של סרטן הערמונית יותר גבוהה בביופסיה הטרנס פריניאלית.
תמונה של ביופסיה טרנס-פריניאלית ניתן לראות בקישור הבא
נראה כי היתרונות של הביופסיה טרנס-פרניאלית מצדיקים את הביצוע שלה למרות החיסרון שבצורך בהרדמה.
למידע כללי – במסגרת הפיענוח של הדמיית ה MRI ישנה שיטת דרוג החשד להמצאות הגידול הסרטני בערמונית. הדרוג נקרא PIRADS. לפי שיטת דרוג זו דרגות 1-2 PIRADS משמעותן סיכוי נמוך למציאת סרטן ולרוב לא מקובל לבצע ביופסיה לממצאים אלו (אך חשוב להתייעץ עם האורולוג המטפל מכיוון שאי ביצוע ביופסיה תלוי גם בגורמים אחרים). דרגות 4-5 PIRADS מסמלות ממצאים בעלי רמת חשד גבוהה לממצא סרטני ולכן חובה לדגום ממצאים אלו (ע"י ביצוע ביופסיה פיוז'ן). דרגה 3 היא סיכון בינוני וכיום ההמלצות הן לדגום גם את הממצאים בעלי דרגת חשד זו.
לפיכך, אין אנו מציעים לבצע Fusion biopsy בכל מקרה באופן אוטומטי אלא לאמץ במיוחד את חמש ההתוויות הבאות לביצוע Fusion biopsy:
- נבדק שהתגלה אצלו בבדיקה רקטאלית ידנית גושים ברקמת הערמונית ושלא עשה לפני כן ביופסיה (עם PSA עולה או עם PSA רגיל, אך לא כאלה עם PSA גבוה מאד, כאמור לעיל).
- נבדק שנעשתה לו ביופסיה עיוורת בעבר, שבה לא התגלתה רקמה סרטנית אך ה PSA אצלו ממשיך לעלות.
- חולים אשר אצלם נתגלה סרטן הערמונית ברמה נמוכה מאד ואשר נמצאים במעקב פעיל. בד"כ נעשית, לחולים אלה, ביופסיה חוזרת אחרי שנה מהאבחון הראשון. זאת כדי לעקוב אחר התפתחות מחלתם וקבלת החלטה מושכלת האם להמשיך במעקב או שלהציע להם טיפול אקטיבי. גם כאן Fusion biopsy תבוצע במידה ובתמונת ה MRI מבחינים רקמה הסרטנית שבערמונית.
- נבדקים שלהם יש ערמונית מוגדלת מאד (מעל 80 גרם) – ערמונית בגודל רגיל הינה במשקל שבין 25 ל 35 גרם. בביצוע הביופסיה הסטנדרטית מקוים שהדגימות המוצאות מהערמונית אכן יוצאו מהרקמה הסרטנית ויביאו לאבחון נכון של המחלה. כאשר נפח הערמונית גדול כ"כ הסיכוי לפגוע ברקמה הסרטנית קטן יותר ויכול להביא לאבחון שגוי. לכן יש לבצע זאת בטכניקה של Fusion biopsy.
- נבדק עם PSA עולה כאשר זמן ההכפלה של ה PSA קטן מ- 5 שנים.
הגדרה – זמן ההכפלה של ה PSA הוא הזמן בו ה PSA מכפיל את ערכו. נקרא בקיצור PSADT
PSA Doubling Time= PSADT
לדוגמא – נניח שמישהו בדק PSA והתוצאה הייתה 2 ולאחר שנה מדידת ה- PSA הראתה 4. זאת אומרת שה PSADT (הליניארי) של ה PSA הינו 1 שנה.
נוסחא לחשוב PSADT (זמן ההכפלה הליניארי של ה PSA) היא:
| (PSADT=(ΔT*PSA1)/(PSA2-PSA1) |
כאשר
ΔT הוא משך הזמן בין שתי הבדיקות (בשנים)
PSA1 היא תוצאת בדיקת ה PSA הראשונה
PSA2 היא תוצאת בדיקת ה PSA השניה.
מתי לא מומלץ לבצע ביופסיה פיוז'ן –
מטופל שברור שאצלו הרקמה הממאירה בערמונית מפושטת (עם PSA גבוה וגם בדיקה רקטאלית חיובית באופן ברור). במקרה זה, מאחר והרקמה הסרטנית כנראה תופשת נפח גדול בערמונית והיא עשויה להראות היטב בהדמיית האולטרה סאונד ולכן אין צורך בשילוב תמונת ה MRI. במקרה כזה פשוט לא כדאי לחכות בתור ל MRI ואח״כ לביופסיה פיוז׳ן עצמה (תהליך שלוקח בד"כ כמה חודשים) אלא למהר ולעשות ביופסיה ״עיוורת״ זאת כדי לא להשהות את התחלת הטיפול במחלה שכנראה הינה מחלה מפושטת ודחוף לאפיין אותה על מנת להתחיל טיפול שידכא אותה ויעצור את התפשטותה.
לדוגמא – מטופל עם PSA 40 כדאי שיוותר עם ביצוע ביופסיה פיוז'ן וימהר לעשות ביופסיה עיוורת. אין כמעט ספק שמחלתו המתקדמת תתגלה גם בביופסיה העיוורת והוא יוכל להתחיל טיפול מיד לאחר קבלת תוצאות הביופסיה הנ"ל.
החומר מבוסס בחלקו על כתבה מטעם Greater Boston Urology
להלן סרטון על ביופסיה פיוז'ן (באנגלית):
ביופסיית "In-bore"
לאחרונה מתפתחת טכניקה משופרת של ביופסיה פיוז'ן הנעשית בתוך מכשיר ה MRI (ביופסיית In-bore הנקראת גם MRGB בספרות), שנעשית במרכז הרפואי שיבא תל השומר ואולי גם במקומות אחרים.
נראה שבדיקת MRGB יותר מדוייקת מ-FGB גם אם לפעמים הפערים לא מובהקים סטטיסטית.
לקישור להסבר באתר של שיבא לחץ כאן
3. הסבר לגבי בדיקת 4K SCORE
4K-Score היא בדיקת דם שעוזרת להגיע להחלטה האם לבצע ביופסיה לערמונית.
בדיקת הדם נלקחת מהמטופל באופן פשוט, ולאחר מכן נשלחת למעבדה למספר ימים, בה נבדקים ארבעה חלבונים המהווים סמנים להימצאות גידול סרטני בעל סיכון לממאירות אגרסיבית. אם החלבונים קיימים בדם המטופל ברמה גבוהה, קיים סיכוי רב לכך שהנבדק חלה בסרטן הערמונית. בדיקת 4K-Score פותחה במשך כעשור במרכז 'ממוראיל סלואן קטרינג' Memorial Sloan Kettering ( אחד מהמרכזים הידועים והמובילים בעולם לחקר הסרטן).
מטרת הבדיקה -מניעת בדיקה פולשנית (ביופסיה לערמונית), אבחון מוקדם והגדרת הסיכון של המחלה
מחקרים שבוצעו בתחום היו ארוכי טווח ובהיקף רחב, ועלה מהם כי מטופלים עם תוצאת 4K-Score נמוכה לא פיתחו גרורות במשך 10 שנים. מניעת ביופסיה פולשנית לערמונית, אבחון מדויק, וחיזוי הופעת גרורות ל 10 שנים קדימה, מהווים יתרונות משמעותיים של בדיקה זו.
הבדיקה עשויה למנוע כ – 40% מהביופסיות הנעשות כיום. כמו כן הבדיקה מאפשרת לחזות את הסיכון להתפתחות גרורות מרוחקות [Distance metastasis] (כלומר במקומות בגוף הרחוקים מהערמונית – (שאלו מסוכנות יותר מגרורות קרובות הממוקמות באזור הערמונית) בתוך 10 שנים שלאחר הבדיקה.
אם לדוגמא, מגיע מטופל בגיל 50 ומעלה עם נתון 4K-Score נמוך מ 7.5%, כנראה שהסרטן שלו לא יפתח גרורות מרוחקות וכי אין לו סכנת מוות בעשר השנים הבאות״.
The 4Kscore Test Biomarkers Can Predict the Probability of Distant Metastases Within 20 Years
להלן כמה מקורות מידע:
למידע (מטעם היצרן) וסרטון (רפי קראסו מראיין את פרופ' עופר נתיב) על בדיקת 4Kscore לחץ כאן:
לכתבה ב Ynet לחץ כאן
לתמונה עם דו"ח שמתקבל לאחר הבדיקה לדוגמא (מטעם היצרן) המראה תוצאות בדיקה שבהן הנבדק הוא בסיכון נמוך (2%) וההמלצה שבדוגמא שאין צורך בביופסיה ואפשר להישאר במעקב פעיל. לדוגמא הקש כאן.
על מחקרים חדשים (מטעם היצרן) בנושא קרא כאן
לסיכום:
אלה שלושת התנאים שבהם מומלץ לבצע בדיקת 4K score לפני ההחלטה על ביצוע ביופסיה לערמונית:
- אם רמת ה PSA אצלך עלתה לאחרונה במידת מה מעבר למקובל, אבל עדיין נמוכה (נמוכה מ -10 ??).
- לא התגלו אצלך בבדיקה הרקטאלית גושים או רקמה שאינה הומגנית חשודה.
- בבדיקת MRI לערמונית התגלה חשד לסרטן ערמונית ברמה PIRADS 1 או 2.
- ואין ודאות שלקית בסרטן הערמונית
אם ארבעת התנאים הנ"ל מתקיימים – כדאי שתעבור בדיקת 4K SCORE.
עברת בדיקת 4K SCORE. אם תוצאת הבדיקה נמוכה מ 7.5% אתה כנראה יכול לוותר על הביופסיה ולחזור לאורולוג ולהיות אצלו במעקב פעיל.
אם התוצאה של בדיקת ה 4K SCORE גבוהה מ 7.5% – עליך לבצע ביופסיה לערמונית.
האם קיימים הסדרי תשלום מול קופות החולים?
הערה – בדיקת 4K-Score אינה נמצאת בסל התרופות, אך קופות החולים מכסות לעיתים חלק מעלות הבדיקה. זאת כנראה מהסיבה שהבדיקה עשויה לחסוך ביופסיה לערמונית, שהיא יקרה הרבה יותר.
לסיכום
לסיום הפרק הארוך הזה אני מציג מפת דרכים המסכמת את הנאמר לעיל.
כדי לקבל החלטה מושכלת על ביצוע/אי ביצוע ביופסיה לערמונית ואיזה ביופסיה מומלץ לעקוב בדקדקנות על מפת הדרכים .
למעבר למפת הדרכים לחץ כאן